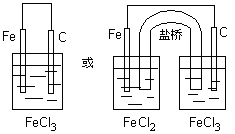
首先标明电子转移方向,根据电子转移方向判断正负极材料——失电子的为负极,得电子的为正极,其次选择相应的物质构成两个半电池——失电子金属和对应的产物构成一个半电池、得电子的离子和一较不活泼的金属或石墨构成另一半电池,最后用盐桥和导线组成闭合回。
3.化学腐蚀实质:金属和非电解质或其他物质相接触直接发生氧化还原反应而引起的腐蚀。其腐蚀过程没有电流产生。
6.在同一电解质溶液中,金属腐蚀的快慢可用下列关系判断:电解原理引起的腐蚀原电池引起的腐蚀化学腐蚀有防护措施的腐蚀。
阳极:(1)若阳极是由活性材料(除C、Pt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子而被氧化成阳离子;
(2)若阳极是由C、Pt、Au等惰性材料做成,阳极反应则是电解液中阴离子在阳极失去电子被氧化。阴离子失去电子能力大小顺序为:I-Br-Cl-OH-含氧酸根F-。


将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁 移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-= Cu2+
【解析】NaCl溶液滴到一块光亮清洁的铁板表面上,一段时间后在液滴覆盖的圆周中心区(a)被腐蚀变暗,实际上是发生了吸氧腐蚀,负极电极反应为:Fe- 2e- = =Fe2+(发生氧化反应)
正极电极反应为:O2+ 2H2O + 4e-==4OH- (发生还原反应);在液滴外沿,由于Fe2++2OH- ==Fe(OH)2 ,4Fe(OH)2+O2 +2H2O == 4Fe(OH)3形成了棕色铁锈环(b)。若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,由于Fe的金属活动性比铜强,Fe仍为负极,负极发生的电极反应为:Fe-2e-==Fe2+。又根据在原电池中,阳离子移向正极,阴离子移向负极的规律,Cl-应由b区向a区迁移。所以A、C、D选项均错误,B选项正确。
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
【解析】可迅速选出C项是错误,因为原电池放电时OH-是向负极移动的。这种电池名称叫锂水电池。可推测其总反应为:2Li+2H2O==2LiOH+H2↑。再写出其电极反应如下:
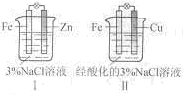
【解析】题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被;A对;I中负极反应式为:Zn-2e-==Zn2+,B错;II极反应式为:2H++2e-==H2↑,C错;I中没有Fe2+,D错;选A。
本账号隶属于三好网,全国最具影响力的高中化学学习服务平台,每天提供最新的知识总结、学习方法、解题技巧、高考资讯、励志文章及在线答疑!







