今天中学化学园给大家分享电化学的知识清单,并配有基础和能力提升训练,希望对大家有所帮助~~~
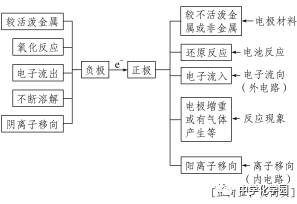
(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(3)三看是否形成闭合回,形成闭合回需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。
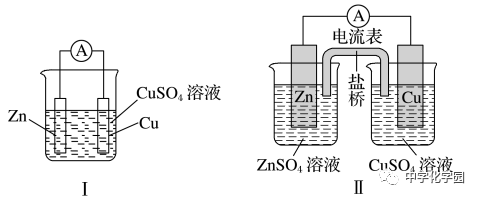
(3)图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的,又有一部分化学能成了热能,装置的温度会升高。
图Ⅱ中Zn和CuSO4溶液分别在两个池子中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能成了电能,电流稳定,且持续时间长。
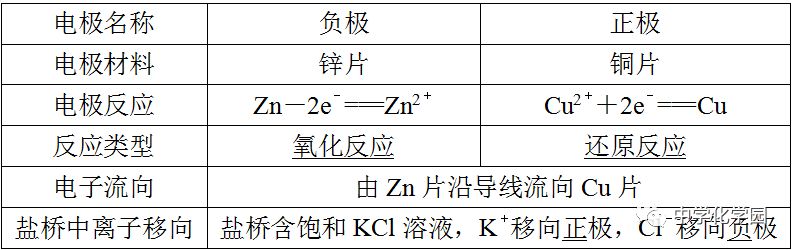
说明原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成"活泼电极一定作负极"的思维定势。
2.当氧化剂得电子速率与还原剂失电子速率相等时,可应达到化学平衡状态,电流表指针示数为零;当电流表指针往相反方向偏转,暗示电中电子流向相反,说明化学平衡移动方向相反。
使被的金属制品作原电池正极而得到。例如,要一个铁质的输水管道或钢铁桥梁等,可用导线将其与一块锌块相连,使锌作原电池的负极。
一个自发进行的氧化还原反应,设计成原电池时反应速率增大。例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
1.将过量的两份锌粉a、b分别加量的稀硫酸,同时向a中加入少量的CuSO4溶液,请画出产生H2的体积V(L)与时间t(min)的关系图像。

(1)加入Cu或CuSO4,形成原电池,加快反应速率,加入Cu不影响Zn的量,但加入CuSO4,Zn的量减少,是否影响产生H2的量,应根据Zn、H+的相对量多少判断。
(2)加入强碱弱酸盐,由于弱酸根与H+反应,使c(H+)减小,反应速率减小,但不影响生成H2的量。
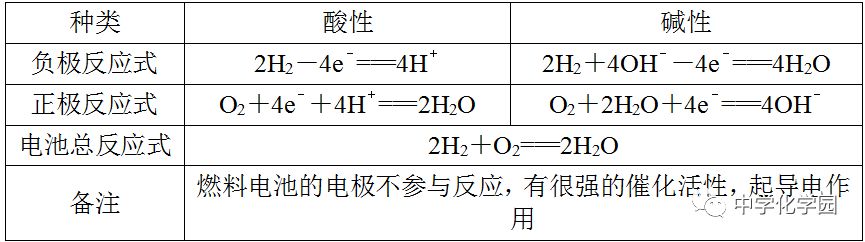
"书写电极反应式(1)先确定原电池的正、负极,列出正、负极上的反应物质,并标出相同数目电子的得失。
(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上的反应物质是
2,且电解质溶液为中性或碱性,则水必须写入正极反应式中,且O2生成OH-,若电解质溶液为酸性,则H+必须写入正极反应式中,O2生成水。(3)正、负极反应式相加得到电池反应的总反应式。若已知电池反应的总反应式,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得到较难写出的另一极的电极反应式。
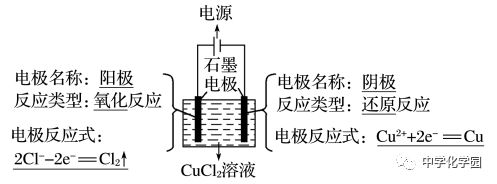
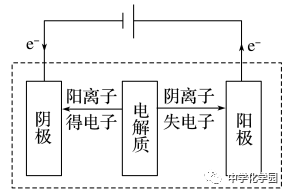
电解时,在外电中有电子通过,而在溶液中是依靠离子定向移动形成电流,即电子本身不会通过电解质溶液。4
①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序:阳极:Cl-OH-;阴极:Ag+Cu2+H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
用分析电解过程的思维程序分析电解下列物质的过程,并总结电解规律(用惰性电极电解)。(1)电解水型
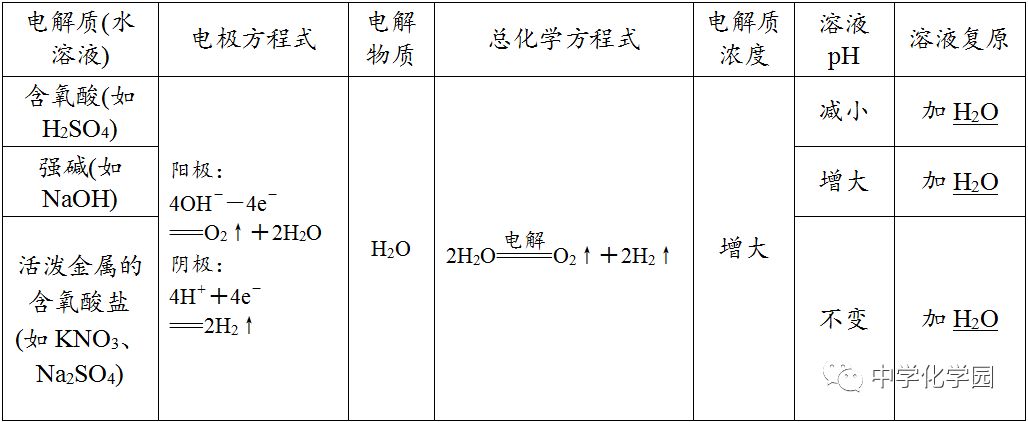
不一定,如用惰性电极电解饱和Na2SO4溶液,一段时间后会析出Na2SO4·10 H2O晶体,剩余溶液仍为该温度下的饱和溶液,此时浓度保持不变。②
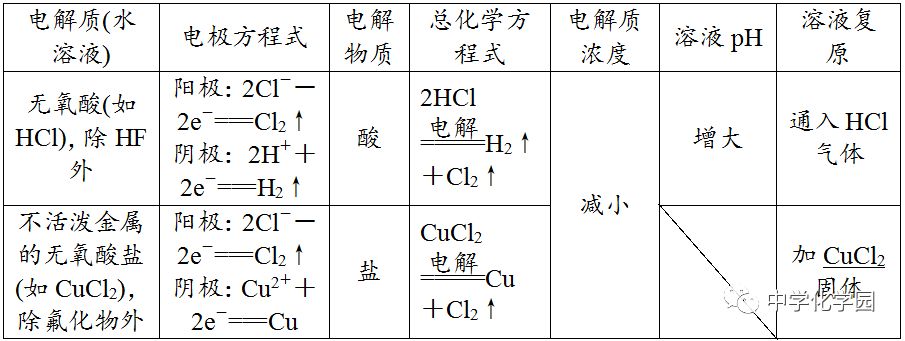
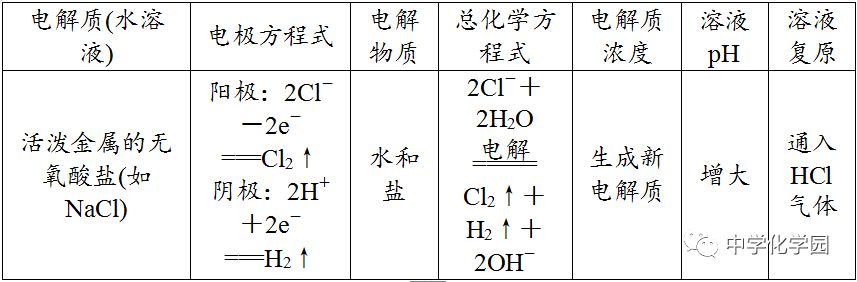
不可以,电解NaCl溶液时析出的是等物质的量的Cl2和H2,所以应通入氯化氢气体,加入盐酸会引入过多的水。(4)放
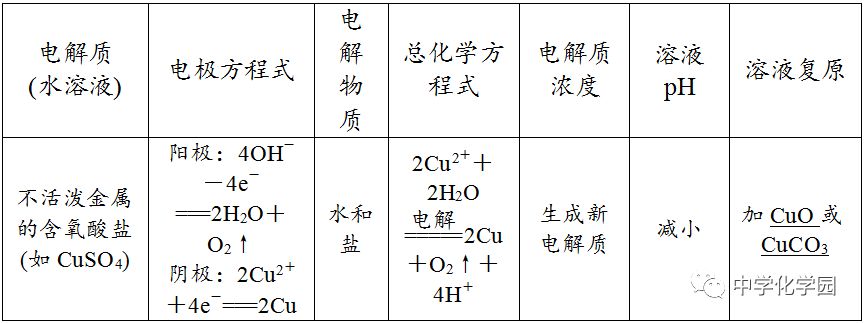
、Pt除外)作阳极,金属一定被电解(注:Fe生成Fe2+)。(2)二看介质,介质是否参与电极反应。
规避"三个"失分点(1)书写电解池中电极反应式时,一般以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成式。
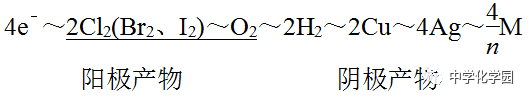
为金属,n为其离子的化合价数值)该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。
在电化学计算中,还常利用Q=I·t和Q=n(e-)×NA×1.60×10-19C来计算电中通过的电量。装置图比较
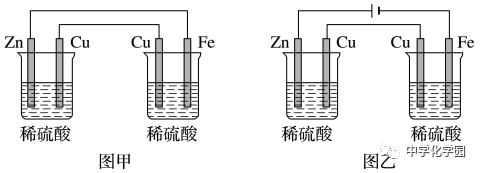
),为电解装置提供电能,其中两个电极活动性差异大者为原电池装置,即左图为原电池装置,右图为电解装置。图乙中有外接电源,两烧杯均作电解池,且电解,通过的电流相等。考点七金属的腐蚀和防护1.
原电池原理引起的腐蚀化学腐蚀有防腐措施的腐蚀。(2)对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中
弱电解质溶液中非电解质溶液中。(3)活动性不同的两种金属,活动性差别越大,腐蚀速率越快。
"介质"溶液的酸碱性是分析析氢腐蚀和吸氧腐蚀的关键。潮湿的空气、酸性很弱或中性溶液发生吸氧腐蚀;NH4Cl溶液、稀H2SO4等酸性溶液发生析氢腐蚀。点击







